
Водород – эффективный источник энергии, который можно получить самостоятельно без сложного оборудования. Для бытового использования чаще всего применяют электролиз воды и химические реакции с металлами, такими как цинк или алюминий. Эти методы не требуют дорогостоящих материалов и позволяют контролировать процесс с минимальными рисками.
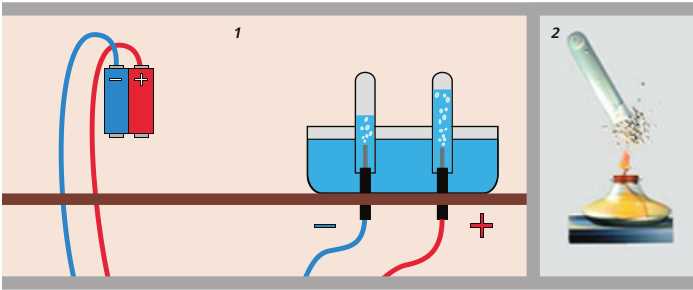
Электролиз воды – самый доступный способ. Для него понадобится источник постоянного тока (аккумулятор или адаптер), две электроды из нержавеющей стали или углеродного материала и дистиллированная вода с добавлением электролита (например, пищевой соды). При прохождении тока вода разлагается на водород и кислород, которые собираются отдельно. Производительность зависит от силы тока и площади электродов.
Химический метод основан на реакции металлов с водой или кислотами. К примеру, цинк в щелочной среде выделяет водород без выделения токсичных продуктов. Для домашнего использования важна точная дозировка реагентов и обеспечение хорошей вентиляции, чтобы избежать накопления газа. Водород, полученный таким способом, можно использовать в небольших экспериментах или как демонстрационный материал.
Получение водорода электролизом воды с использованием бытовых электролитов
Для получения водорода методом электролиза в домашних условиях используют обычную воду с добавлением электролитов, обеспечивающих проводимость. В качестве электролитов применяют пищевую соду (карбонат натрия), поваренную соль (хлорид натрия) или уксусную кислоту (раствор уксуса). Наиболее безопасным и эффективным вариантом считается сода в концентрации 5–10 г на литр воды.
Электролиз проводят в емкости из пластика или стекла с двумя электродами из нержавеющей стали или угля, подключёнными к источнику постоянного тока напряжением 6–12 В. Ток при этом должен быть ограничен до 1–2 А, чтобы избежать излишнего нагрева и разрушения электродов.
В процессе электролиза на катоде выделяется водород, а на аноде – кислород. Использование соли ускоряет процесс за счёт большей электропроводности, но приводит к выделению хлора, что опасно и требует хорошей вентиляции помещения. При применении соды или уксуса выделение вредных газов незначительно, что делает их предпочтительными для домашнего использования.
Для сбора водорода применяют перевёрнутые в ёмкости с электролитом пробирки или пластиковые бутылки с узким горлом. Время электролиза напрямую зависит от площади электродов и силы тока: при токе 1 А с площадью контакта около 10 см² за 1 час выделяется примерно 0,9 литра водорода при нормальных условиях.
Обязательно контролируйте процесс, так как накопление газовой смеси требует осторожности из-за взрывоопасности. Не допускайте попадания искр или открытого огня вблизи установки. После завершения электролиза сначала отключают питание, затем аккуратно отсоединяют электроды.
Применение алюминиевых аккумуляторов для выделения водорода

Алюминиевые аккумуляторы содержат алюминий, который при взаимодействии с водой способен выделять водород. Для домашнего получения газа этот метод требует соблюдения точных условий и мер безопасности.
Основные этапы и рекомендации:
- Выбор аккумулятора: предпочтительны старые или неисправные алюминиевые аккумуляторы с незначительным остатком электролита, чтобы избежать сильного коррозионного воздействия.
- Подготовка раствора: для ускорения реакции используется разбавленный гидроксид натрия (NaOH) или гидроксид калия (KOH) с концентрацией 1–3%. Чистая вода реакцию практически не запускает.
- Процесс выделения водорода: погружение алюминиевого анода в щелочной раствор вызывает химическую реакцию:
- 2Al + 6H2O + 2OH⁻ → 2[Al(OH)4]⁻ + 3H2↑
- Контроль температуры: реакция экзотермична, температура раствора может подниматься до 40–50 °C. Рекомендуется поддерживать температуру в пределах 25–40 °C для стабильного выделения водорода.
- Сбор газа: водород собирается с помощью перевернутой водной ёмкости или специализированного газоотводящего оборудования, чтобы избежать попадания кислорода и взрывоопасных смесей.
- Меры безопасности:
- Работа в хорошо проветриваемом помещении или на открытом воздухе.
- Использование защитных очков и перчаток при работе с щелочами и аккумуляторами.
- Запрет на открытый огонь и искрообразование рядом с реакционной зоной.
Данный метод подходит для ограниченного получения водорода в малых объёмах с использованием бытовых материалов. Для повышения эффективности и безопасности рекомендуется использовать специальные реакторы и контролировать концентрацию щёлочи.
Использование цинка и кислоты для генерации водорода дома
Реакция между цинком и кислотой – один из самых простых и доступных способов получить водород в домашних условиях. В качестве кислоты чаще всего применяют разбавленную соляную кислоту (HCl) концентрацией 10–15%. Цинк можно взять в виде чистых пластин, стружки или порошка, продающихся в хозяйственных или химических магазинах.
Для проведения реакции подготовьте устойчивый стеклянный или пластиковый сосуд с узким горлышком, чтобы минимизировать контакт с воздухом и избежать разбрызгивания. Поместите в сосуд цинк – примерно 10–20 грамм. Аккуратно влейте кислоту, чтобы покрыть металл полностью, но не превышайте объем в 100 мл для безопасного контроля реакции.
При контакте цинка с кислотой происходит выделение газа по уравнению: Zn + 2HCl → ZnCl₂ + H₂↑. Реакция начинается с пузырьков, которые быстро увеличиваются, указывая на интенсивный выход водорода. Для ускорения процесса лучше использовать цинковый порошок, так как увеличивается площадь контакта с кислотой.
Рекомендуется проводить эксперимент в хорошо проветриваемом помещении или на улице. Собранный газ можно направлять через трубку в емкость с водой для очистки от возможных кислотных паров. Важно соблюдать меры предосторожности: кислота агрессивна и может вызвать ожоги при попадании на кожу, а водород – легко воспламеняем.
После окончания реакции остатки раствора нейтрализуют слабым раствором соды, а сосуды тщательно промывают. Такой способ позволяет получить до 1 литра водорода при реакции 0,03 моль цинка с 0,06 моль кислоты (примерно 2 грамма цинка с 20 мл кислоты), что достаточно для демонстрационных опытов и изучения свойств газа.
Разложение перекиси водорода с катализаторами для выделения газа
Перекись водорода (H₂O₂) при взаимодействии с катализаторами распадается на воду и кислород, выделяя газ, который в определённых условиях можно использовать для получения водорода. Основные катализаторы – растворы перманганата калия, диоксид марганца (MnO₂), и ионы йода.
Образующийся газ – кислород, а не водород. Однако при добавлении металлических порошков, например цинка или алюминия, в присутствии перекиси и катализатора, происходит дополнительное восстановление, с выделением водорода. Это требует аккуратности и строгого контроля концентраций, чтобы избежать бурных реакций.
Концентрация перекиси не должна превышать 10%, поскольку выше возрастает риск взрывоопасных реакций и разбрызгивания. Для ускорения реакции MnO₂ можно измельчать до порошкообразного состояния, увеличивая площадь контакта. Использование ионных катализаторов, например йодида калия, требует дозировки около 0,01 г на 100 мл перекиси и проявляет более медленное и контролируемое выделение газа.
Сбор газа рекомендуется вести через систему с водяным затвором и емкостью, рассчитанной на избыточное давление не менее 0,2 атмосферы. Собранный кислород можно применять для окислительных процессов или в качестве окислителя, но для получения чистого водорода метод требует дополнительной химической доработки.
Получение водорода с помощью реакции магния с водой

Магний реагирует с водой с образованием водорода и гидроксида магния. Для начала реакции необходима нагретая вода или пар, так как при комнатной температуре реакция протекает крайне медленно из-за образования пассивного слоя оксида магния на поверхности металла.
Оптимальная температура воды – от 60 до 90 °C. В условиях нагрева магний быстро растворяется с выделением газа. Рекомендуется использовать магниевую ленту или стружку с максимальной площадью поверхности для ускорения процесса. Концентрация воды должна быть максимальной, лучше применять дистиллированную воду без примесей, чтобы избежать посторонних реакций.
Для запуска реакции достаточно погрузить магний в нагретую воду, после чего наблюдается активное выделение пузырьков водорода. Реакция описывается уравнением: Mg + 2H₂O → Mg(OH)₂ + H₂↑.
Для повышения выхода водорода и предотвращения образования оксидной пленки допускается добавление небольшого количества соляной кислоты (1–2%), что ускоряет растворение магния. Однако это увеличивает коррозионную активность и требует осторожности при работе.
Все операции рекомендуется проводить в хорошо проветриваемом помещении и с использованием защитных средств, так как водород – легковоспламеняющийся газ. Сбор водорода осуществляют с помощью вытеснения воды или воздушного пространства в сосуде.
Извлечение водорода из бытового газа методом катализа
Для получения водорода из бытового газа (природного газа или сжиженного нефтяного газа) используется каталитический паровый риформинг – реакция паровой конверсии метана с использованием катализатора на основе никеля или платиновых металлов. Процесс протекает при температуре 700–900 °C и давлении 1,5–3 МПа.
Ключевые этапы: пропускание смеси паров воды и бытового газа через слой катализатора; разложение метана с образованием водорода и оксида углерода (CO); последующая конверсия CO с образованием дополнительного водорода и углекислого газа (CO2).
Соотношение пар/газ должно быть 2,5–3:1 для предотвращения образования углеродистых отложений на катализаторе и повышения выхода водорода. Для домашнего оборудования рекомендуются никелевые катализаторы с высокой поверхностной площадью, обеспечивающие стабильность при длительной эксплуатации.
Для эффективного извлечения водорода важна точная поддержка температуры и давления, а также предварительная очистка бытового газа от серосодержащих примесей, которые активируют деактивацию катализатора. Использование систем автоматического контроля параметров процесса существенно увеличивает безопасность и эффективность.
В результате можно получить смесь, содержащую до 75–85% водорода по объему. Для выделения чистого водорода применяется последующая очистка мембранными технологиями или адсорбцией на цеолитах.
Использование бытовых аккумуляторов и электролитов для самостоятельного производства водорода
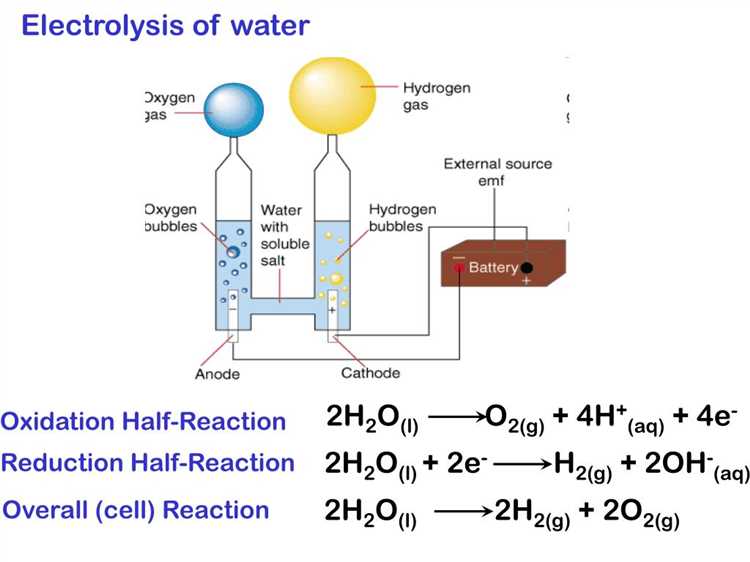
Для получения водорода в домашних условиях применяют электролиз воды с помощью бытовых свинцово-кислотных аккумуляторов и электролитов, таких как раствор пищевой соды или серной кислоты низкой концентрации. Типичная схема включает источник питания с напряжением 6–12 В, две электроды из инертного металла (например, нержавеющей стали) и контейнер с электролитом.
Раствор соды готовят из расчёта 10–20 г на 1 литр воды. Это увеличивает электропроводность и снижает сопротивление, обеспечивая стабильный ток электролиза. Свинцово-кислотный аккумулятор выдерживает длительную нагрузку до 5 А, что оптимально для процесса без риска перегрева.
Подключение электродов производится к полюсам аккумулятора, при этом на катоде выделяется водород, а на аноде – кислород. Для безопасного сбора газов рекомендуется использовать герметичную ёмкость с системой отвода и обратного клапана.
Время работы зависит от ёмкости аккумулятора и концентрации электролита. При токе 2 А с 1 литра раствора можно получить примерно 10–12 литров водорода за час. Необходимо регулярно контролировать температуру электролита – превышение 50 °C ускоряет деградацию аккумулятора и электродов.
Для увеличения эффективности применяют пластины с большой площадью поверхности и избегают контакта между электродами. Перед использованием аккумулятор необходимо полностью зарядить. При работе важно соблюдать меры безопасности: избегать коротких замыканий, использовать защитные очки и перчатки.
Техника безопасности при работе с домашними установками для получения водорода

Водород – легковоспламеняющийся и взрывоопасный газ. При работе с домашними установками важно строго соблюдать правила безопасности для предотвращения аварий и повреждений.
- Работать только в хорошо проветриваемом помещении или на открытом воздухе, чтобы избежать накопления газов.
- Обеспечить надежное герметичное соединение всех трубок и шлангов, чтобы исключить утечки водорода.
- Использовать материалы, устойчивые к коррозии и воздействию электролитов (например, нержавеющую сталь, специальные пластики).
- Держать источники огня, искры и горячие предметы не менее чем в 3 метрах от установки.
- Использовать защитные очки и перчатки при работе с электролитами и электрическими контактами.
- Не оставлять установку без контроля во время работы, особенно при использовании электролиза с током выше 1 А.
- Оборудовать место работы огнетушителем класса В или порошковым огнетушителем.
- Перед запуском проверять исправность электрооборудования, избегать использования поврежденных проводов и соединений.
- Избегать смешивания водорода с воздухом в замкнутом объеме – водородная концентрация выше 4% в воздухе уже взрывоопасна.
- При хранении и транспортировке баллонов с водородом использовать специальные крепления и защитные крышки.
Соблюдение этих рекомендаций минимизирует риск возгорания и взрыва, а также защитит здоровье и имущество.
Вопрос-ответ:
Какие материалы и реактивы нужны для получения водорода дома с помощью электролиза?
Для простого электролиза воды в домашних условиях обычно используют источник постоянного тока (например, блок питания или аккумулятор), два электрода (лучше из инертного металла — платины или нержавейки), и раствор воды с добавлением электролита, например, поваренной соли или пищевой соды. Электролит повышает проводимость воды, что ускоряет процесс выделения водорода и кислорода. Важно соблюдать осторожность, чтобы избежать короткого замыкания и скопления взрывоопасных газов.
Можно ли получить водород с помощью реакции металлов с кислотами в домашних условиях?
Да, такой способ применим. Например, цинк или алюминий могут взаимодействовать с разбавленной соляной или серной кислотой, в результате чего выделяется водород. Реакция достаточно быстрая и сопровождается выделением пузырьков газа. Однако при работе с кислотами нужно строго соблюдать меры безопасности: использовать защитные перчатки, очки и работать в хорошо проветриваемом помещении, чтобы избежать ожогов и вредных паров.
Насколько безопасно получать водород дома и какие меры предосторожности следует соблюдать?
Получение водорода в домашних условиях требует внимательности. Водород — легковоспламеняющийся газ, который может образовывать взрывоопасные смеси с воздухом. Нужно избегать скопления газа в закрытых помещениях, обеспечивать хорошее проветривание и не работать рядом с открытым огнём или искрами. Также важно контролировать процессы электролиза или химические реакции, чтобы не допустить перегрева и утечки. Использование защитных средств и соблюдение инструкций поможет минимизировать риски.
Какие преимущества и недостатки у метода получения водорода электролизом по сравнению с химическими способами?
Электролиз воды позволяет получить чистый водород без побочных продуктов, что делает этот способ более экологичным. При этом можно регулировать скорость выделения газа, изменяя силу тока. С другой стороны, для электролиза нужна электроэнергия, что может быть неудобно или затратно в домашних условиях. Химические методы, например с кислотами и металлами, часто быстрее и не требуют электричества, но сопровождаются образованием отходов и требуют аккуратности при работе с реагентами.
Какие домашние приборы или установки можно использовать для сбора и хранения полученного водорода?
Для сбора водорода часто используют водяные вытеснители, например, перевёрнутые заполненные водой пробирки или банки. Водород, будучи легче воздуха, вытесняет воду и заполняет емкость. Для хранения в малых количествах подойдут баллоны или герметичные сосуды, способные выдерживать газ под небольшим давлением. Следует избегать пластиковых контейнеров, которые могут пропускать газ, и обязательно обеспечить безопасность — газ не должен попадать в зоны с огнем или искрами.
Какие материалы и оборудование нужны для получения водорода в домашних условиях с помощью электролиза воды?
Для получения водорода методом электролиза дома обычно необходимы следующие компоненты: источник постоянного электрического тока (например, батарея или блок питания), два электрода из инертного материала (часто используют угольные или платиновые электроды), сосуд с водой, в которую добавляют небольшое количество электролита (чаще всего поваренную соль или раствор соды). Важно обеспечить хорошую изоляцию и соблюдать меры безопасности, так как процесс сопровождается выделением газа, который является легковоспламеняющимся.






