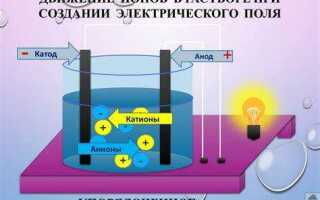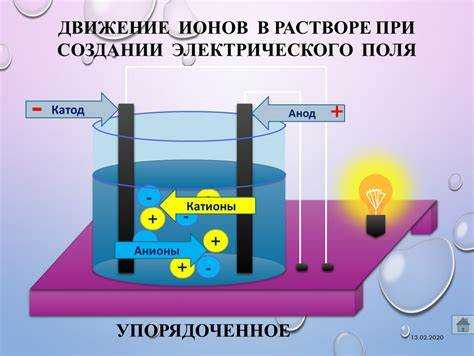
Катод и анод – это электроды, через которые протекает электрический ток в ходе химических реакций. В электрохимических процессах они играют принципиально разные роли, определяя направление движения электронов и ионов. Понимание их функций необходимо при изучении электролиза, гальванических элементов и коррозии металлов.
Катод – это электрод, на котором протекает восстановление. В электролизе катод заряжен отрицательно: к нему притягиваются катионы – положительно заряженные ионы. Эти ионы принимают электроны и превращаются в нейтральные атомы или молекулы. Например, при электролизе хлорида натрия на катоде выделяется водород из воды: 2H+ + 2e— → H2.
Анод – это электрод, на котором происходит окисление. В электролизе он имеет положительный заряд и привлекает анионы – отрицательные ионы. На аноде они теряют электроны. Например, при электролизе того же раствора хлорида натрия на аноде выделяется хлор: 2Cl— → Cl2 + 2e—.
В гальванических элементах полярность меняется: катод становится положительным, потому что именно сюда поступают электроны от анода, где происходит окисление. Такое различие важно учитывать: в электролизе катод – минус, в гальванике – плюс. Это частая ошибка среди начинающих.
Рекомендуется запомнить основное: восстановление – всегда на катоде, окисление – на аноде. Также полезно помнить, что ионы движутся к электродам с противоположным зарядом: катионы – к катоду, анионы – к аноду. Это упрощает понимание любых электрохимических процессов.
Как отличить катод от анода в гальванической ячейке
Гальваническая ячейка состоит из двух электродов, погружённых в растворы своих солей и соединённых внешней цепью. Один из них – катод, другой – анод. Их функции определяются направлением тока и типом протекающих реакций.
- Катод – это электрод, на котором происходит восстановление. Электроны поступают сюда по внешней цепи. Он имеет положительный заряд относительно анода.
- Анод – место окисления. Электроны уходят отсюда во внешнюю цепь. Заряд – отрицательный.
Для точного определения используйте следующие признаки:
- Определите, какой металл легче окисляется. Он будет анодом. Например, цинк легче теряет электроны, чем медь, значит, цинковый электрод – анод.
- Проследите за направлением потока электронов. Электроны всегда идут от анода к катоду.
- Наблюдайте за изменениями на электродах. На аноде металл разрушается (переходит в раствор), на катоде – может выделяться металл или водород.
- Проверьте стандартные электродные потенциалы: электрод с более низким потенциалом – анод.
- Если используется солевой мост, направление движения катионов – к катоду, а анионов – к аноду.
Используя эти критерии, можно точно определить, какой электрод выполняет роль катода, а какой – анода в любой гальванической ячейке.
Почему катод может быть как положительным, так и отрицательным
В гальваническом элементе катод заряжен положительно, потому что электроны поступают на него извне – от анода. На катоде принимаются электроны, восстанавливаются катионы, например:
Cu²⁺ + 2e⁻ → Cu
Здесь медь восстанавливается, оседая в металлической форме. Электроны подаются через внешнюю цепь, катод притягивает положительно заряженные ионы, сам при этом не имея отрицательного потенциала.
В процессе электролиза катод – отрицательный. Электроны подаются на него от внешнего источника тока, ионный ток направлен к катоду. Восстановление происходит за счёт принудительной подачи электронов, например:
Na⁺ + e⁻ → Na
Таким образом, катод заряжается отрицательно, притягивая положительные ионы к себе.
Различие вызвано направлением тока и способом подачи электронов:
- В гальваническом элементе – электроны текут от анода к катоду самопроизвольно.
- В электролизёре – подача электронов происходит от внешнего источника тока.
При анализе электрохимических процессов важно не путать знак катода. Определяющим признаком является тип реакции – восстановление, а не заряд. Поэтому катод может быть как положительным (в источниках тока), так и отрицательным (при электролизе).
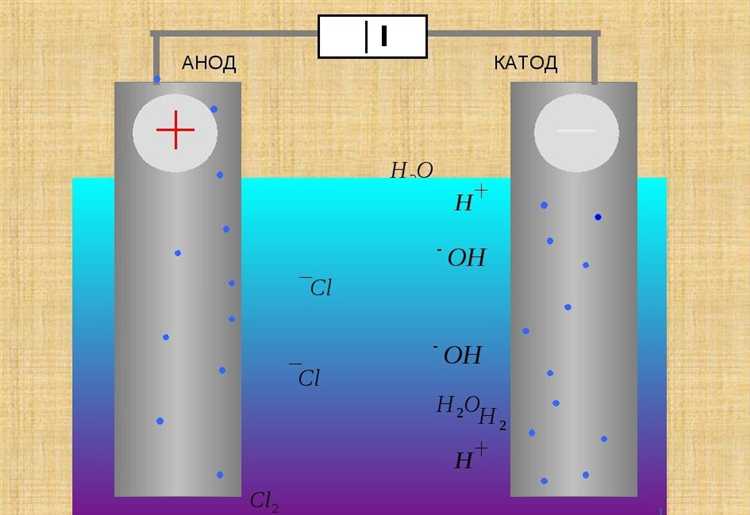
Что происходит на катоде и аноде во время электролиза
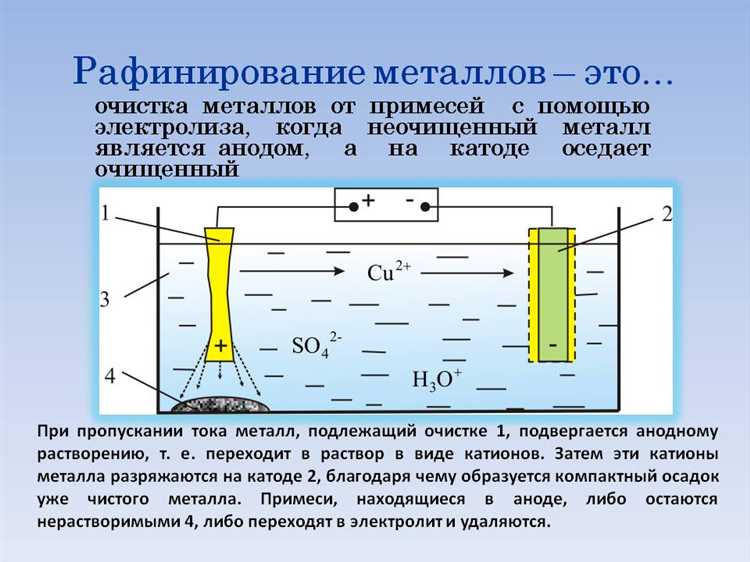
Анод подключён к положительному полюсу и служит местом окисления. Анионы, несущие отрицательный заряд, направляются к аноду и отдают электроны. При электролизе раствора NaCl к аноду движутся ионы Cl⁻. Там они окисляются: 2Cl⁻ → Cl₂ + 2e⁻. Образуется молекулярный хлор, выделяющийся в виде газа.
Если в растворе содержатся ионы воды, возможны конкурирующие реакции. Например, при электролизе разбавленного раствора серной кислоты H₂SO₄, вместо выделения сульфат-ионов SO₄²⁻ на аноде окисляется вода: 2H₂O → O₂ + 4H⁺ + 4e⁻. На катоде в этом случае восстанавливаются ионы водорода: 2H⁺ + 2e⁻ → H₂.
Состав электродов имеет значение. Инертные материалы (графит, платина) не участвуют в реакциях, тогда как активные аноды (например, медные) могут сами окисляться, как при электролизе раствора CuSO₄: Cu (анод) → Cu²⁺ + 2e⁻.
Для получения конкретных продуктов электролиза важно учитывать природу электролита, тип электродов и напряжение. Например, повышенное напряжение может привести к побочным реакциям, таким как разложение воды даже при наличии более лёгких ионов.
Как запомнить, где происходит окисление, а где восстановление
На аноде всегда происходит окисление. Запомнить можно по фразе: «А» – анод, «О» – окисление. Анод теряет электроны, они уходят в цепь. Например, в гальваническом элементе цинк на аноде превращается в ионы Zn²⁺, отдавая два электрона.
На катоде всегда восстановление. Электроны приходят к катоду через проводник и восстанавливают ионы. Например, на катоде может происходить восстановление Cu²⁺ до металлической меди.
Дополнительный способ – правило «ОЖИГ»: Окисление – Жертвенный электрод – Идёт Гулять (электроны уходят). Это помогает представить, что металл «жертвует» своими электронами и окисляется.
В электролизе всё зеркально по току, но процессы остаются прежними: на аноде – окисление, на катоде – восстановление. Главное – запомнить связь процесса с названием электрода, а не с зарядом источника.
Роль катода и анода в коррозии металлов

Катод служит местом восстановления. Здесь принимаются электроны, поступающие с анода по металлической проводящей связи. На катоде может восстанавливаться кислород, например, в кислой среде по уравнению: O₂ + 4H⁺ + 4e⁻ → 2H₂O. Эта реакция усиливает разрушение анодного участка, так как поддерживает ток в цепи.
Разделение функций между катодом и анодом может происходить даже на одной металлической детали. Достаточно наличия неоднородностей: царапин, включений других металлов, неравномерного распределения кислорода или влаги. Это делает металл уязвимым для локальной коррозии, например, питтинга.
Чтобы замедлить коррозию, нужно воздействовать на анодные и катодные процессы. Один из методов – катодная защита: к основному металлу подключают более активный анод (например, цинк), который будет разрушаться вместо основного металла. Также эффективно нанесение покрытий, которые изолируют металл от кислорода и влаги, подавляя катодную реакцию.
Примеры катода и анода в повседневных устройствах
В щелочных батарейках анодом выступает цинковый корпус, отдающий электроны, а катодом – смесь диоксида марганца с углем, принимающая электроны для создания электрического тока.
В литий-ионных аккумуляторах анодом служит графитовый материал, который при зарядке принимает ионы лития, а катодом – оксид металла (например, кобальта), отдающий ионы в электролит.
В электрохимических датчиках кислорода катодом является платиновый электрод, на котором происходит восстановление кислорода, а анодом – электрод из инертного материала, служащий источником электронов.
Электролиз воды проводится между анодом из инертного металла (часто платина или графит), где выделяется кислород, и катодом, на котором образуется водород.
В коррозионной защите металлов анодом становится жертвенный металл, который растворяется, предотвращая повреждение основного металла, играющего роль катода.
Как правильно подписывать электроды в школьных задачах по химии
При выполнении задач по электрохимии важно четко обозначать электроды, чтобы избежать ошибок и правильно понять процесс. Следуйте этим правилам:
- Определите, какой электрод является анодом, а какой катодом.
- Анод – электрод, где происходит окисление (выделение электронов).
- Катод – электрод, где происходит восстановление (прием электронов).
- Используйте стандартные обозначения.
- Анод принято обозначать знаком «–» или словом «анод».
- Катод обозначают знаком «+» или словом «катод».
- При подписывании электродов указывайте полное название или символ вещества.
- Например, «Zn (анод)» или «Cu (катод)».
- Если электрод сделан из инертного материала (например, платина), укажите это.
- При записи электрохимических ячеек используйте двойной вертикальный штрих (||) для обозначения соли-моста или раздела фаз.
- Пример: Zn(s) | Zn²⁺ (aq) || Cu²⁺ (aq) | Cu(s).
- В левой части записи всегда указывается анод, в правой – катод.
- Обозначайте направления тока и движение электронов, если требуется.
- Электроны движутся от анода к катоду.
- Электрический ток считается направленным от катода к аноду (обратное движение электронов).
- Проверяйте, чтобы подписи соответствовали реакции.
- Если идет окисление металла, этот металл – анод.
- Если идет восстановление ионов, соответствующий электрод – катод.
Соблюдение этих правил поможет избежать недоразумений и повысить точность при решении задач с электродами.
Вопрос-ответ:
Что такое катод и анод в химических процессах?
Катод и анод — это электроды, между которыми происходит перенос электрического тока. Катод — это электрод, на котором происходит восстановление, то есть частицы получают электроны. Анод — это электрод, где происходит окисление, то есть вещества теряют электроны. Эти понятия помогают понять, как происходит движение зарядов в химических реакциях, связанных с электричеством.
Почему катод называют отрицательным, а анод — положительным, и всегда ли это так?
В электрохимии катод обычно связывают с отрицательным зарядом, потому что он принимает электроны, а анод — с положительным, так как отдает электроны. Однако в разных устройствах, например в гальванических элементах и электролизерах, заряды могут меняться местами. Главное — помнить, что катод всегда связан с получением электронов, а анод — с их отдачей.
Как определить, где катод, а где анод в химической ячейке?
Чтобы найти катод и анод, нужно понять, в каком направлении движутся электроны. Электроны движутся от анода к катоду. Анод — это электрод, на котором происходит окисление (потеря электронов), а катод — где происходит восстановление (прием электронов). Важным признаком также может быть реакция, которая происходит на электроде: выделение газа или выпадение осадка укажет на тип реакции.
Почему на катоде происходит восстановление, а на аноде — окисление?
На катоде вещества получают электроны, благодаря чему снижается их степень окисления — это процесс восстановления. На аноде, наоборот, вещества теряют электроны, и их степень окисления повышается — происходит окисление. Это связано с тем, что электроны уходят с анода и приходят на катод, создавая разницу в химических реакциях на каждом электроде.
Какая роль катода и анода в батарейках и электролизерах?
В батарейках катод и анод — это места, где происходят химические реакции, обеспечивающие поток электронов по внешней цепи. Анод обычно является источником электронов, а катод их принимает, обеспечивая электрический ток. В электролизерах процесс идет наоборот: внешний источник тока заставляет электроны двигаться, и на катоде восстанавливаются вещества, а на аноде окисляются. Таким образом, эти электроды управляют превращениями веществ в обеих системах.