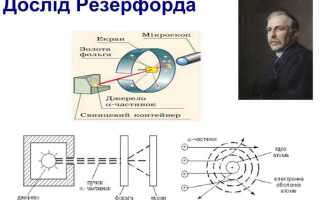
Эксперимент Эрнеста Резерфорда, проведённый в 1909 году, изменил представление о строении атома. Учёных поразило неожиданное отклонение альфа-частиц, которое не соответствовало существовавшей тогда модели атома – модели Томсона. Резерфорд ожидал, что частицы пройдут практически беспрепятственно через атом, однако значительная часть альфа-частиц отразилась под большими углами.
Результаты эксперимента указали на существование компактного ядра с положительным зарядом в центре атома, что стало прямым доказательством его ядерной структуры. Более того, большинство массы атома оказалось сосредоточено именно в этом ядре, а не равномерно распределено, как предполагалось ранее.
Исследователям рекомендуется внимательно изучать аномальные результаты экспериментов и не игнорировать несоответствия теоретическим ожиданиям. Опыт Резерфорда показывает, что даже малые отклонения могут привести к фундаментальным открытиям и пересмотру научных парадигм.
Как альфа-частицы отклонялись от ожидаемой траектории
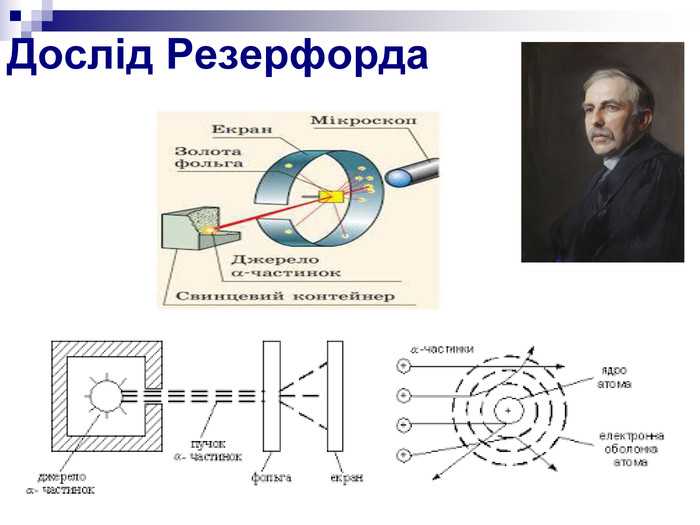
В опыте Резерфорда альфа-частицы с энергией порядка 5 МэВ направлялись на тонкую золотую фольгу толщиной около 100 нанометров. Ожидалось, что частицы пройдут почти прямо, слегка отклоняясь из-за рассеяния на электронах, обладающих малой массой и слабым зарядом.
Однако наблюдения показали, что значительная часть альфа-частиц отклонялась под углами до 90 градусов и более, а некоторые даже отражались почти обратно к источнику. Угол отклонения доходил до 150 градусов, что противоречило классическим представлениям.
Причиной такого отклонения оказалось наличие в атоме компактного и сильно заряженного ядра. Альфа-частицы, приближаясь к ядру с зарядом +79e, испытывали мощное кулоновское отталкивание. Из-за малого радиуса ядра (~10⁻¹⁴ м) и высокой концентрации положительного заряда взаимодействие с ним происходило точечно и интенсивно.
Для уменьшения вероятности рассеяния исследователи рекомендовали использовать сверхтонкие фольги, чтобы альфа-частицы не теряли энергию на множественных столкновениях, а также применять детекторы с высокой пространственной разрешающей способностью для точного измерения углов отклонения.
Экспериментальные данные позволили построить формулы для зависимости вероятности отклонения от угла, что впоследствии легло в основу модели ядерного строения атома и расчёта распределения зарядов внутри ядра.
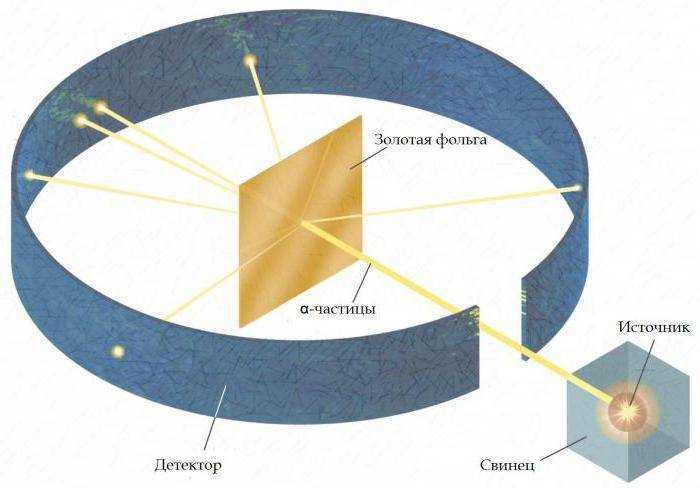
Почему большая часть частиц проходила через золотую фольгу без изменений
Альфа-частицы в опыте Резерфорда обладали большой кинетической энергией и несли положительный заряд. Золотая фольга представляла собой слой толщиной около 0,00004 мм, что соответствовало примерно нескольким сотням атомных слоев. Несмотря на это, альфа-частицы практически не взаимодействовали с большинством атомов фольги.
Это объясняется тем, что атомы состоят в основном из пустого пространства. Ядра атомов, обладающие положительным зарядом и высокой плотностью, занимают ничтожную часть объёма атома – примерно 1/100000000 от общего размера атома. Электроны, обладающие отрицательным зарядом, расположены далеко от ядра и имеют массу, ничтожно малую по сравнению с альфа-частицами, поэтому их влияние на траекторию частиц было незначительным.
В результате большинство альфа-частиц проходило через фольгу без заметного отклонения, поскольку вероятность близкого столкновения с ядром была крайне мала. Сила электростатического отталкивания ядра воздействовала только при очень малом расстоянии, которое встречалось редко из-за разрежённости атомной структуры.
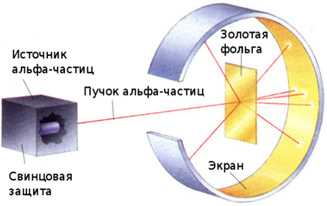
Причина резких отражений альфа-частиц в эксперименте
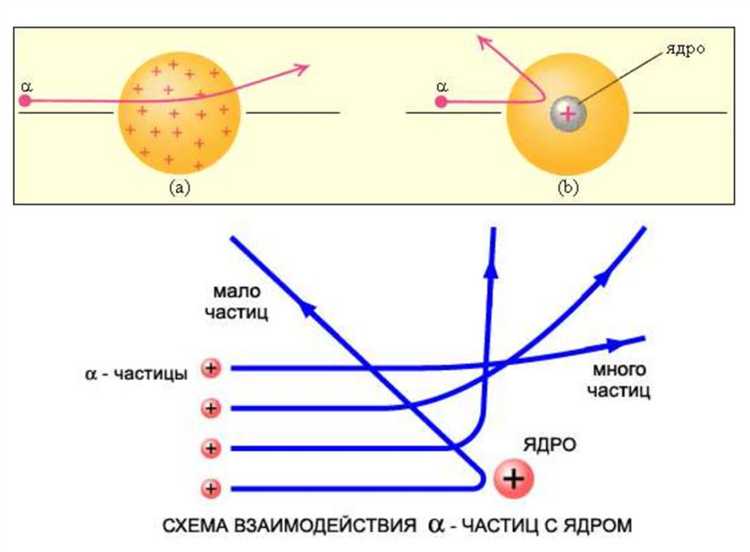
В опыте Резерфорда альфа-частицы неожиданно отражались под большими углами, включая почти полное возвращение. Это происходило из-за взаимодействия с плотным положительно заряженным ядром атома золота. Несмотря на малые размеры ядра – порядка 10-14 метров – его заряд создавал сильное электростатическое поле.
Когда альфа-частица, имеющая положительный заряд и энергию около 5 МэВ, приближалась к ядру, отталкивание усиливалось экспоненциально, поскольку расстояние сокращалось до размеров порядка 10-14 метров. В результате альфа-частица резко меняла направление, испытывая эффект отражения.
Такое поведение указывало на то, что атом состоит преимущественно из пустого пространства, а вся положительная зарядка сосредоточена в компактном ядре. Именно взаимодействие с ядром, а не с электронной оболочкой, вызывало резкие отклонения.
Роль ядерной структуры в объяснении результатов опыта
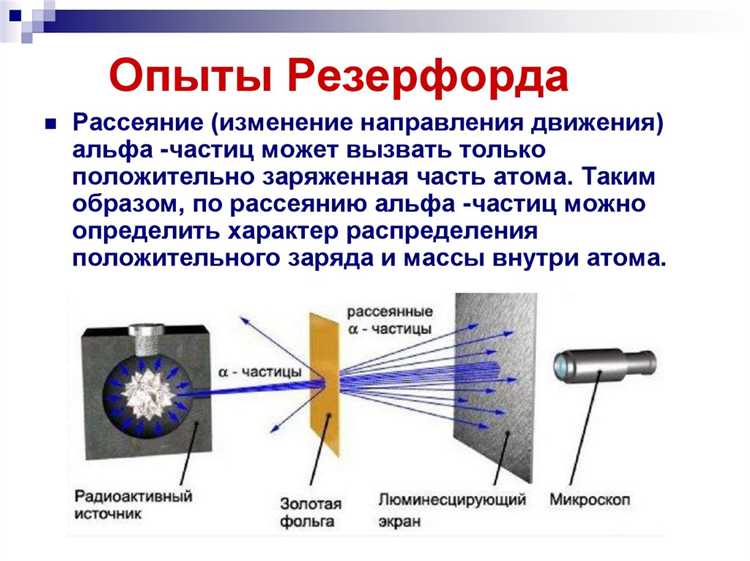
В эксперименте Резерфорда альфа-частицы, направленные на тонкую золотую фольгу, в подавляющем большинстве проходили практически без отклонения, однако небольшая часть отражалась под большими углами, включая обратное направление. Такое поведение невозможно объяснить равномерным распределением положительного заряда по всему объёму атома, как предполагалась ранее.
Резерфорд предположил, что весь положительный заряд и основная масса атома сосредоточены в малом объёме – ядре, диаметр которого по сравнению с атомом чрезвычайно мал. Эта ядерная структура обусловила концентрированное электростатическое поле, способное отклонять альфа-частицы с высокой кинетической энергией.
Размер ядра Резерфорд оценил примерно в 10⁻¹⁴ метра, что в несколько десятков тысяч раз меньше размера атома (~10⁻¹⁰ м). Такое соотношение объясняет, почему большинство частиц проходили свободно, не испытывая заметных взаимодействий, тогда как столкновение с ядром приводило к резким отклонениям.
Таким образом, наблюдения в опыте стали первым убедительным доказательством существования компактного ядра, что радикально изменило представления о внутренней структуре атома и заложило основу для дальнейшего развития ядерной физики.
Как опыт изменил представление о строении атома
До эксперимента Резерфорда господствовала модель атома Томсона, согласно которой атом представлял собой однородный положительный «пудинг» с вкраплениями отрицательно заряженных электронов. Альфа-частицы, по предположению, должны были проходить через такой атом без значительных отклонений.
Результаты эксперимента показали, что:
- Большинство альфа-частиц действительно проходило через золотую фольгу почти без изменения траектории.
- Некоторая часть частиц отклонялась под большими углами, а отдельные частицы даже отражались назад.
Это указывало на наличие в атоме очень компактного и плотного центра – ядра, сосредоточенного на небольшой площади и обладающего положительным зарядом, который мог отталкивать альфа-частицы.
- Атом состоит из плотного ядра, где сосредоточена почти вся масса и положительный заряд.
- Электроны расположены на значительном расстоянии от ядра, занимая большую часть объема атома.
- Большое пространство внутри атома является практически пустым, что объясняет прохождение большинства альфа-частиц без отклонений.
Опыт Резерфорда положил начало современной ядерной физике и стимулировал разработку моделей атома с ядром, что впоследствии привело к созданию планетарной модели и квантовой механики. Для понимания строения материи стало необходимым учитывать именно существование компактного ядра, а не однородного распределения заряда.
Эксперимент Резерфорда выявил, что атомное ядро занимает чрезвычайно малую часть объёма атома – порядка 10⁻¹⁴ метра по диаметру, что примерно в 10 000 раз меньше самого атома. При этом большая часть массы сосредоточена именно в ядре, что указывало на его высокую плотность.
Расчёты, основанные на рассеянии альфа-частиц, показали, что ядро обладает плотностью порядка 2·10¹⁷ кг/м³, что сопоставимо с плотностью нейтронных звёзд. Такой уровень плотности полностью изменил представление о внутренней структуре материи, исключив модель равномерного распределения массы в атоме.
Открытие малого размера ядра объясняло, почему большинство альфа-частиц проходили через фольгу без отклонения – пространство вокруг ядра было практически пустым для этих частиц. Резерфорд рекомендовал использовать эти данные для дальнейших экспериментов по изучению сил взаимодействия внутри ядра и их влияния на стабильность атомов.
Методы измерения углов отклонения и их точность

В эксперименте Резерфорда углы отклонения альфа-частиц фиксировались с помощью люминесцентного экрана, покрытого сульфидом цинка, который светился при попадании частиц. Наблюдатели регистрировали световые вспышки, определяя направление отклонения по шкале углов, нанесённой вокруг экрана.
Точность измерений зависела от разрешающей способности экрана и угловой шкалы. Шкала была разделена на интервалы примерно по 1°, что обеспечивало приблизительную оценку отклонений с точностью до ±0,5°. Величина ошибок учитывалась при анализе распределения углов отражения.
Для повышения надёжности результатов использовали многократные наблюдения и статистический метод – фиксировали количество вспышек в каждом угловом секторе, что позволяло выявлять закономерности несмотря на случайные ошибки измерений.
Вопрос-ответ:
Почему большинство альфа-частиц проходило через золотую фольгу без отклонения в опыте Резерфорда?
В опыте Резерфорда большая часть альфа-частиц не меняла направление, потому что атомы в основном состоят из пустого пространства. Золотая фольга была очень тонкой, и альфа-частицы редко сталкивались с плотным ядром, которое занимает крайне малую часть объёма атома. Это объясняет, почему только небольшая доля частиц отклонялась, а большинство проходило практически прямо.
Что именно удивило учёных в количестве частиц, отражённых обратно от фольги?
Учёных поразило то, что некоторое число альфа-частиц отражалось почти обратно, как от твердой преграды. Согласно тогдашним представлениям, атом должен был быть равномерно заполнен положительно заряженной массой, что не предполагало таких сильных отражений. Этот факт заставил пересмотреть модель атома, поскольку подобное поведение могло означать наличие очень маленького, но плотного центра — ядра.
Какие методы использовались для измерения углов отклонения альфа-частиц в опыте?
Для определения углов отклонения применяли сцинтилляционный экран, покрытый сульфидом цинка, который светился в момент попадания на него альфа-частицы. Наблюдая за вспышками через микроскоп, исследователи фиксировали угол, под которым частица отклонялась после взаимодействия с фольгой. Такой подход позволял с высокой точностью оценить направление движения отдельных частиц после столкновения.
Почему результаты эксперимента опровергли распространённую на тот момент модель атома?
Ранее считалось, что атом имеет равномерное распределение положительного заряда, в котором свободно движутся электроны. Ожидалось, что альфа-частицы должны проходить через атом без существенного отклонения. Однако наблюдения за резким отражением и значительным отклонением части частиц не совпадали с этой теорией. Это означало, что положительный заряд сосредоточен в небольшой области — ядре, что противоречило идее равномерного распределения.
Как опыт Резерфорда повлиял на дальнейшее понимание строения атома?
Эксперимент заставил учёных пересмотреть устройство атома, выделив в нём центральное ядро с большим положительным зарядом и практически всю массу атома. Это открыло путь к новой модели, где электроны вращаются вокруг ядра, а не равномерно распределены внутри атома. Такая структура объяснила наблюдаемые отклонения частиц и стала основой для развития квантовой механики и ядерной физики.
Что именно в опыте Резерфорда поразило учёных?
Ученые были удивлены тем, что большинство альфа-частиц проходили через тонкую золотую фольгу практически без отклонений, хотя ожидали их рассеяния в разных направлениях. Особенно неожиданным стало то, что небольшое количество частиц отражалось назад под большими углами, что говорило о наличии в атоме очень компактного и тяжёлого центра — ядра. Этот факт противоречил тогдашним представлениям, согласно которым атомы были равномерно заполнены веществом, и частицы не должны были так резко отражаться. Открытие ядра заставило пересмотреть всю модель строения атома.