
Скорость диффузии прямо зависит от температуры, что объясняется увеличением средней кинетической энергии частиц. При повышении температуры молекулы движутся быстрее, что сокращает время, необходимое для их перемещения из области с высокой концентрацией в область с низкой. Этот эффект подтверждается уравнением Эйнштейна – Смолуховского, в котором коэффициент диффузии пропорционален температуре и обратно пропорционален вязкости среды.
Например, при температуре 20 °C диффузия кислорода в воде происходит со скоростью около 2,0 × 10⁻⁹ м²/с, тогда как при 40 °C этот показатель увеличивается почти вдвое. Такие изменения особенно важны в биологических системах и промышленных процессах, где контроль температуры позволяет управлять скоростью переноса веществ.
Для повышения эффективности процессов, связанных с диффузией (например, сушки, экстракции, катализа), рекомендуется использовать терморегулируемую среду. Важно учитывать, что слишком высокая температура может привести к разрушению термочувствительных веществ или увеличению побочных реакций, поэтому расчет оптимального температурного диапазона должен учитывать физико-химические свойства компонентов.
В инженерной практике используется эмпирическое правило: при увеличении температуры на каждые 10 °C скорость диффузии возрастает примерно в 1,4–1,5 раза, если не происходит фазовых переходов или изменений структуры среды. Это позволяет прогнозировать поведение системы при варьировании температуры и выбирать режимы работы оборудования с учетом требований к интенсивности переноса массы.
Как изменение температуры влияет на кинетическую энергию молекул
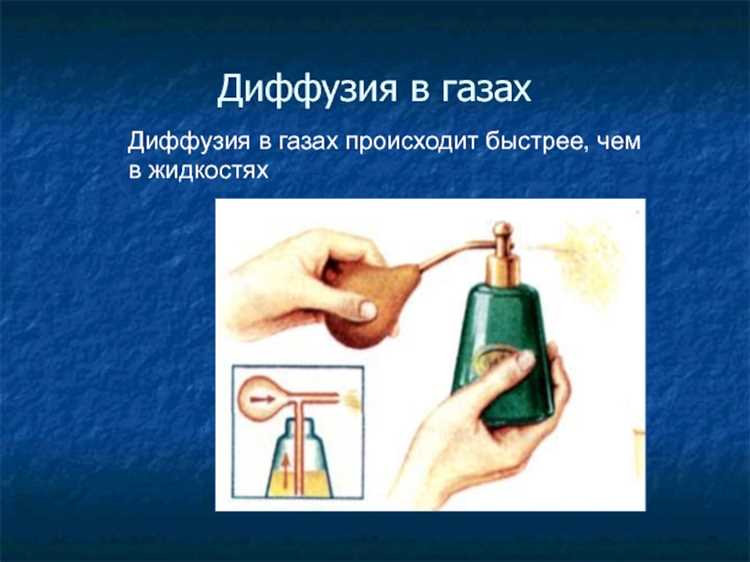
Кинетическая энергия молекул прямо пропорциональна температуре, выраженной в кельвинах. Согласно уравнению Ek = (3/2)kT, где k – постоянная Больцмана (1,38×10−23 Дж/К), а T – абсолютная температура, при увеличении температуры возрастает и средняя энергия движения частиц.
Даже незначительное повышение температуры приводит к ускорению молекулярного движения, что усиливает частоту и силу столкновений. Это объясняет, почему вещества смешиваются быстрее при нагревании – скорость диффузии возрастает вместе с кинетической активностью молекул.
- При 273 К (0 °C) средняя кинетическая энергия молекул газа составляет около 5,65×10−21 Дж.
- При повышении температуры до 373 К (100 °C) эта энергия увеличивается до примерно 7,72×10−21 Дж.
Это увеличение энергии приводит к:
- Росту скорости перемещения молекул в газах и жидкостях.
- Снижению влияния межмолекулярных связей, особенно в вязких средах.
- Увеличению проникающей способности частиц в твёрдых телах при высоких температурах.
Для практического наблюдения влияния температуры на кинетическую энергию можно провести эксперимент с окрашенными растворами: при комнатной температуре окрашивание воды происходит медленно, но стоит нагреть её на 30–40 °C, как окрашивание ускоряется в 2–3 раза. Это отражает рост кинетической энергии и, следовательно, скорости диффузии.
Почему при нагревании вещества ускоряется перемешивание газов
Повышение температуры приводит к увеличению средней кинетической энергии молекул газа. Это означает, что молекулы начинают двигаться быстрее и с большей частотой сталкиваются друг с другом, что существенно увеличивает интенсивность диффузионных процессов.
Скорость перемешивания газов напрямую зависит от их молекулярной подвижности. При нагревании молекулы совершают больше хаотических перемещений за единицу времени, сокращая расстояние, за которое они могут равномерно распределиться в объёме. Например, при повышении температуры воздуха с 20 °C до 40 °C коэффициент диффузии кислорода в азоте возрастает примерно на 20 %, что заметно ускоряет перемешивание компонентов.
Важно учитывать, что в условиях повышенного давления эффект температуры сохраняется, но его выраженность может снижаться из-за увеличения числа столкновений между молекулами. Поэтому в замкнутых и плотных системах при анализе перемешивания следует корректировать температурные расчёты с учётом давления и состава газовой смеси.
Практическая рекомендация: при необходимости ускорить перемешивание газов в лабораторных или производственных условиях, повышение температуры на 10–15 °C может дать выраженный эффект без изменения состава или объёма системы. Однако важно контролировать, чтобы температура не превышала пределы устойчивости веществ к нагреванию.
Роль температуры в скорости диффузии в жидкостях
В жидкостях молекулы находятся в плотном контакте, и процесс диффузии осуществляется за счёт теплового движения частиц. Повышение температуры приводит к увеличению средней кинетической энергии молекул, что напрямую влияет на их способность преодолевать межмолекулярные взаимодействия и ускоряет перемешивание компонентов.
Скорость диффузии в жидкой среде описывается уравнением Эйнштейна – Стокса:
D = kT / (6πηr),
где D – коэффициент диффузии, k – постоянная Больцмана, T – абсолютная температура, η – вязкость жидкости, r – радиус диффундирующей частицы. Из уравнения видно, что при прочих равных условиях увеличение температуры приводит к росту D, особенно если при этом уменьшается вязкость.
- В воде при 20 °C коэффициент диффузии глюкозы составляет около 6,7 × 10-10 м²/с, тогда как при 40 °C он увеличивается до 8,9 × 10-10 м²/с.
- Для ионов натрия в физиологическом растворе рост температуры с 25 °C до 37 °C ускоряет диффузию примерно на 30%.
Практическое значение этой зависимости проявляется, например, в биохимических реакциях: при нагревании тканей ускоряется доставка веществ к клеткам, а в промышленных процессах – повышается эффективность экстракции и растворения.
- Избегайте хранения растворов при пониженных температурах, если требуется быстрое перемешивание компонентов.
- При проектировании систем жидкостного переноса учитывайте вязкостные изменения при нагреве – высокая температура снижает вязкость, способствуя более быстрой диффузии.
- Для точного контроля скорости диффузии используйте термостатирование, особенно при исследовательских или фармацевтических задачах.
Таким образом, температура играет критически важную роль в определении скорости диффузии в жидкостях, и её регулирование позволяет управлять множеством физических и химических процессов.
Сравнение влияния температуры на диффузию в твердых телах и газах
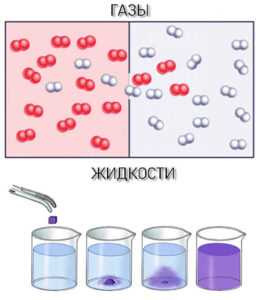
В газах диффузия усиливается с ростом температуры значительно быстрее, чем в твердых телах. Это связано с высокой подвижностью молекул и практически отсутствием межмолекулярных связей. Увеличение температуры на 10 °C может удвоить скорость диффузии газа. Например, для кислорода при температуре 0 °C коэффициент диффузии составляет около 1,8×10⁻⁵ м²/с, а при 100 °C – уже свыше 3,5×10⁻⁵ м²/с.
В твердых телах атомы находятся в узлах кристаллической решетки, и их перемещение возможно лишь за счёт термически активируемых переходов через энергетические барьеры. Повышение температуры увеличивает вероятность таких переходов, но эффект менее выражен. Для большинства металлов коэффициент диффузии при комнатной температуре не превышает 10⁻¹⁵ м²/с, а при 500 °C – порядка 10⁻¹¹ м²/с. Таким образом, даже значительный нагрев приводит к относительно медленному росту скорости диффузии.
Для инженерных расчётов важно учитывать, что в газах диффузия начинает играть роль уже при малых изменениях температуры, тогда как в твердых материалах её вклад становится заметным только при высокотемпературных условиях – например, в процессе спекания или термообработки. При проектировании тепловых процессов в твердых телах стоит использовать уравнение Аррениуса с учётом энергии активации, тогда как для газов достаточно учитывать зависимость от средней кинетической энергии молекул.
Температурная зависимость коэффициента диффузии

Коэффициент диффузии (D) характеризует скорость переноса вещества в среде и напрямую зависит от температуры. Для газов эмпирически установлено, что D пропорционален T3/2 и обратно пропорционален давлению: D ∝ T3/2 / P. Это объясняется возрастанием средней кинетической энергии молекул при нагревании и, соответственно, увеличением их подвижности.
В жидкостях температурная зависимость описывается уравнением Стокса-Эйнштейна: D = kT / (6πηr), где k – постоянная Больцмана, T – абсолютная температура, η – вязкость среды, r – радиус частицы. Рост температуры снижает вязкость и увеличивает тепловое движение, что ведёт к росту D. Например, для воды увеличение температуры с 20 °C до 40 °C приводит к увеличению коэффициента диффузии ионов почти в два раза.
Для твёрдых тел температурная зависимость экспоненциальна и подчиняется уравнению Аррениуса: D = D0exp(−Q/RT), где D0 – предэкспоненциальный множитель, Q – энергия активации, R – газовая постоянная, T – температура в Кельвинах. Это уравнение отражает необходимость преодоления потенциального барьера для атомов в кристаллической решётке. При нагреве металлов в диапазоне 500–800 °C коэффициент диффузии может возрастать на несколько порядков.
Для инженерных расчётов и моделирования важно учитывать, что даже небольшое изменение температуры способно существенно изменить коэффициент диффузии, особенно в высокотемпературных процессах. Поэтому при проектировании тепловых и химических систем необходимо использовать температурно-зависимые значения D, полученные экспериментально или из справочных источников, учитывающих конкретную среду и вещество.
Практический пример: как температура влияет на запахи в помещении
При повышении температуры воздуха скорость диффузии молекул запаха в помещении увеличивается экспоненциально. Согласно уравнению Аррениуса, коэффициент диффузии возрастает примерно на 10-15% при увеличении температуры на каждые 10 °C. Например, если при 20 °C молекулы запаха распространяются со скоростью около 0,1 см²/с, то при 30 °C этот показатель может достигать 0,11-0,115 см²/с.
Это приводит к более быстрому и равномерному распространению запахов, что особенно заметно в замкнутых пространствах с ограниченной вентиляцией. При комнатной температуре 22-24 °C запахи распространяются медленнее, создавая локальные зоны концентрированного аромата. При повышении до 28-30 °C интенсивность запаха становится более равномерной и ощущается быстрее во всей комнате.
В бытовой практике это важно учитывать при использовании ароматизаторов или устранении неприятных запахов. Чтобы минимизировать распространение нежелательных запахов, рекомендуется снижать температуру воздуха, понижая скорость диффузии молекул и замедляя их перемешивание с воздухом. Обратное верно для быстрого распространения приятных ароматов – их лучше активировать при повышенной температуре.
Также температура влияет на испарение веществ, образующих запах. С увеличением температуры испаряемость возрастает, усиливая концентрацию молекул в воздухе и, соответственно, скорость диффузии. В условиях высокой температуры (выше 30 °C) концентрация запаха может увеличиваться в 1,5-2 раза за счет ускоренного испарения.
Для контроля запахов рекомендуется поддерживать температуру воздуха в помещении в диапазоне 18-22 °C, что снижает скорость диффузии и испарения, а также использовать эффективную вентиляцию для удаления молекул запаха. При необходимости быстрого распространения ароматов целесообразно увеличить температуру и обеспечить активное перемешивание воздуха.
Температурные условия при хранении и смешивании веществ в лаборатории

Температура существенно влияет на скорость диффузии веществ, что необходимо учитывать при хранении и смешивании реактивов в лабораторных условиях. Для газов повышение температуры ускоряет диффузионные процессы, что может привести к нежелательным потерям или загрязнению при недостаточно герметичной упаковке. Оптимальная температура хранения газов обычно составляет от 0 до 25 °C с контролем влажности.
Жидкие вещества при увеличении температуры демонстрируют повышение коэффициента диффузии примерно на 5–10% на каждые 10 °C, что ускоряет смешивание, но при этом возрастает риск испарения и изменения концентрации. При смешивании реактивов рекомендуется проводить процессы при температуре, максимально приближенной к лабораторной комнатной (20–22 °C), чтобы обеспечить стабильность состава и минимизировать изменение вязкости растворов.
Для твердых веществ диффузия протекает значительно медленнее, однако при хранении выше 30 °C возможно увеличение скорости миграции примесей, что снижает чистоту образцов. Следует избегать резких колебаний температуры, так как это может вызвать конденсацию влаги и агрегацию частиц, нарушая гомогенность смесей.
При подготовке растворов учитывайте, что при охлаждении ниже 5 °C диффузия замедляется, что может замедлить реакционные процессы, а при нагревании выше 40 °C увеличивается вероятность термического разложения компонентов. Рекомендуется выдерживать реактивы и смеси в диапазоне 15–25 °C для оптимального баланса между скоростью диффузии и стабильностью состава.
| Температурный режим | Влияние на диффузию | Рекомендации |
|---|---|---|
| 0–5 °C | Значительное замедление диффузии | Хранение веществ, требующих низкой активности |
| 15–25 °C | Оптимальная скорость диффузии для большинства растворов | Рекомендуемая температура для смешивания и хранения |
| 25–40 °C | Увеличение скорости диффузии, риск испарения и разложения | Использовать с осторожностью, контролировать условия |
| Выше 40 °C | Резкое повышение скорости диффузии и вероятность термического разрушения | Не рекомендуется без специальных условий |
Контроль температуры при технологических процессах с участием диффузии
Для контроля температуры рекомендуется использовать системы с точностью поддержания ±0,5 °C, особенно в процессах, где необходимы стабильные и повторяемые результаты. Неправильное температурное управление может привести к неравномерному распределению вещества, дефектам структуры и снижению функциональных характеристик материалов.
В таблице представлены ориентировочные коэффициенты диффузии для типичных материалов при разных температурах, что позволяет оценить необходимый температурный режим для заданной скорости диффузии.
| Материал | Температура, °C | Коэффициент диффузии, м²/с |
|---|---|---|
| Кремний (легирование фосфором) | 900 | 1.5 × 10⁻¹³ |
| Кремний (легирование бора) | 1000 | 4.0 × 10⁻¹³ |
| Медь в меди | 500 | 3.0 × 10⁻¹⁵ |
| Кислород в железе | 700 | 1.2 × 10⁻¹² |
Для точного контроля температуры в промышленности используют термопары, инфракрасные датчики и системы автоматического регулирования с обратной связью. Важна также равномерность нагрева – локальные перепады температуры могут создавать зоны с различной скоростью диффузии, что негативно сказывается на однородности материала.
При оптимизации технологического процесса следует учитывать энергоэффективность: повышение температуры ускоряет диффузию, но требует большего энергопотребления и может вызвать деградацию компонентов. Поэтому баланс между температурой и временем выдержки обеспечивает необходимую скорость диффузии без ухудшения качества.
Вопрос-ответ:
Почему скорость перемещения молекул увеличивается при повышении температуры?
При нагревании молекул увеличивается их кинетическая энергия, они начинают двигаться быстрее и активнее сталкиваться друг с другом. Это ускоряет процесс перемешивания и распространения веществ, что и приводит к увеличению скорости диффузии.
Как изменение температуры влияет на процесс диффузии в твердых телах по сравнению с газами?
В газах молекулы двигаются свободно и быстро, поэтому повышение температуры заметно увеличивает скорость их движения, что сильно ускоряет диффузию. В твердых телах движение молекул ограничено кристаллической решёткой, и повышение температуры способствует активации процессов, таких как перемещение дефектов или вакансий, через которые происходит диффузия. Из-за этого эффект повышения температуры в твердых телах проявляется менее интенсивно, чем в газах.
Почему при низких температурах скорость диффузии резко падает?
При низких температурах молекулы имеют меньшую энергию и двигаются медленнее, что снижает частоту столкновений и общий уровень активности в веществе. Это затрудняет их перемещение и обмен позициями, поэтому процесс диффузии замедляется, иногда значительно.
Можно ли оценить скорость диффузии в зависимости от температуры с помощью математической формулы?
Да, скорость диффузии часто описывается уравнением Аррениуса, где коэффициент диффузии зависит от температуры экспоненциально: D = D0 * exp(-Ea / (R * T)). Здесь D0 — предэкспоненциальный множитель, Ea — энергия активации процесса, R — универсальная газовая постоянная, T — абсолютная температура. Формула показывает, что с ростом температуры экспоненциально увеличивается коэффициент диффузии.






