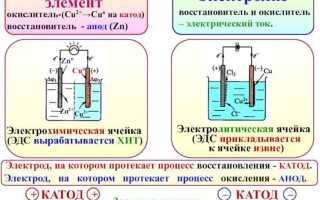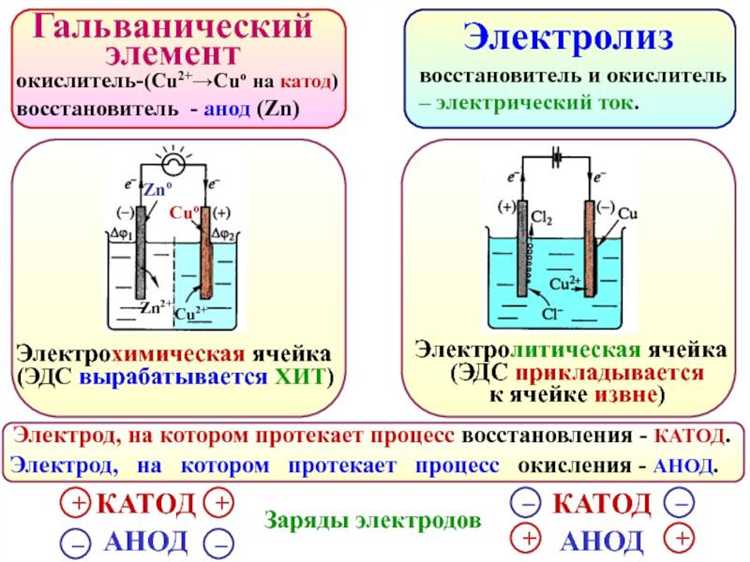
Работа любого гальванического элемента основана на взаимодействии двух различных электродов, каждый из которых выполняет строго определённую функцию. Один из них – анод – служит источником электронов и окисляется в процессе, другой – катод – принимает электроны и участвует в восстановлении. Их роли не зависят от положения в цепи, а определяются исключительно типом протекающей электрохимической реакции.
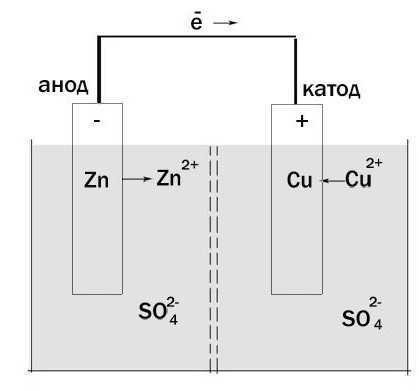
В большинстве классических элементов, таких как цинк-медный Daniell Cell, отрицательным электродом является цинковый анод. Он теряет электроны, переходя в раствор в виде ионов Zn²⁺. Положительным электродом становится медный катод, на котором оседают ионы меди из раствора, восстанавливаясь до металлической формы. Направление движения электронов всегда от анода к катоду, что и определяет ток в цепи.
Выбор материалов для электродов напрямую влияет на электродный потенциал и выходное напряжение элемента. Например, использование магния вместо цинка позволит получить более высокий потенциал, но потребует учёта большей коррозионной активности. Поэтому при конструировании гальванических источников важно точно знать, какой металл станет анодом, а какой катодом, и как это отразится на характеристиках устройства.
Правильное понимание роли положительного и отрицательного электрода необходимо не только для теоретического анализа, но и для практического применения: от подбора аккумуляторов до проектирования топливных элементов. Нарушение этого баланса может привести к снижению эффективности, ускоренному разрушению материалов и выходу элемента из строя.
Как определить полярность электродов в гальваническом элементе
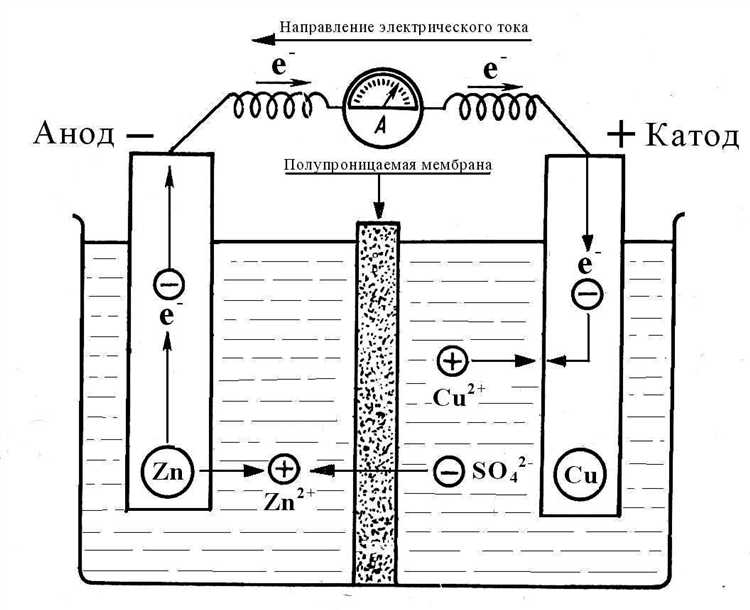
В типичном цинк-медном элементе цинковый электрод является анодом: Zn → Zn²⁺ + 2e⁻. Здесь цинк отдает электроны, и электрод становится отрицательно заряженным. Электроны движутся через внешнюю цепь к медному электроду, на котором восстанавливаются ионы: Cu²⁺ + 2e⁻ → Cu. Таким образом, медный электрод – катод, он положительный.
Если состав гальванического элемента неизвестен, можно использовать вольтметр. Подключая щупы к электродам, и наблюдая знак на дисплее, можно определить, какой электрод положителен. Если измеренное напряжение положительное, щуп, подключённый к катоду (положительному электроду), соединён с плюсом прибора.
Для лабораторных условий удобен индикаторный электрод (например, платиновый с известной полярностью), соединённый через солевой мост. Сравнение потенциалов позволит выявить, на каком электроде происходит окисление, а на каком восстановление, даже без прямого измерения ЭДС.
Также полярность можно предсказать с помощью таблицы стандартных электродных потенциалов. Чем выше значение электродного потенциала (E⁰), тем выше склонность вещества восстанавливаться, следовательно, электрод с более высоким E⁰ будет катодом.
Чем отличается анод от катода в контексте гальванического элемента

В гальваническом элементе анод и катод выполняют противоположные функции, определяемые направлением движения электронов и характером происходящих окислительно-восстановительных реакций. Эти различия имеют прямое влияние на выбор материалов электродов и их взаимодействие с электролитом.
- Анод – это электрод, на котором протекает окисление. Он отдает электроны во внешнюю цепь. В гальваническом элементе анод всегда является отрицательным электродом, так как именно с него электроны начинают движение.
- Катод – электрод, на котором происходит восстановление. Он принимает электроны из внешней цепи и поэтому является положительным электродом.
Пример: в цинк-медном гальваническом элементе цинк (Zn) – анод. Он окисляется, превращаясь в Zn2+ и теряя два электрона. Эти электроны движутся через внешнюю цепь к медному катоду (Cu), где ионы Cu2+ из раствора восстанавливаются до металлической меди.
- Анод – источник электронов, материал должен легко окисляться (например, цинк, магний).
- Катод – приемник электронов, материал должен способствовать восстановлению (например, медь, графит).
Выбор анода и катода должен учитывать электродные потенциалы. Электрод с более низким стандартным электродным потенциалом становится анодом, а с более высоким – катодом. Это позволяет предсказать направление электрохимических процессов и рассчитать ЭДС элемента.
Какие материалы чаще всего используются для положительного и отрицательного электродов
Выбор материалов для электродов гальванического элемента определяется электрохимическим потенциалом, устойчивостью к коррозии и стоимостью. От этих факторов зависит эффективность и срок службы элемента.
Для положительного электрода (катода) часто применяют материалы, способные эффективно принимать электроны и устойчивые к восстановлению:
- Диоксид марганца (MnO₂) – используется в солевых и щелочных элементах. Обеспечивает стабильную работу при низкой стоимости.
- Оксид серебра (Ag₂O) – применяется в серебряно-цинковых батареях, отличается высокой плотностью энергии и стабильностью потенциала.
- Оксид меди (CuO) – встречается в некоторых типах первичных элементов, особенно в учебных и демонстрационных целях.
- Двуокись свинца (PbO₂) – характерна для свинцово-кислотных аккумуляторов, обладает высокой электропроводностью и прочностью.
Для отрицательного электрода (анода) выбирают материалы, которые легко отдают электроны и окисляются при разряде:
- Цинк (Zn) – самый распространённый анодный материал в солевых, щелочных и цинк-воздушных элементах. Он легко окисляется, обеспечивая устойчивую электрохимическую реакцию.
- Литий (Li) – используется в литиевых элементах благодаря чрезвычайно высокому удельному заряду и низкому стандартному потенциалу.
- Свинец (Pb) – применяется в свинцово-кислотных аккумуляторах, эффективно работает в паре с PbO₂.
- Кадмий (Cd) – встречается в никель-кадмиевых аккумуляторах, но его использование ограничено из-за токсичности.
При проектировании элементов учитываются и дополнительные параметры, такие как растворимость продуктов реакции, плотность тока, температурная устойчивость и совместимость с электролитом.
Как направление тока связано с выбором электродов
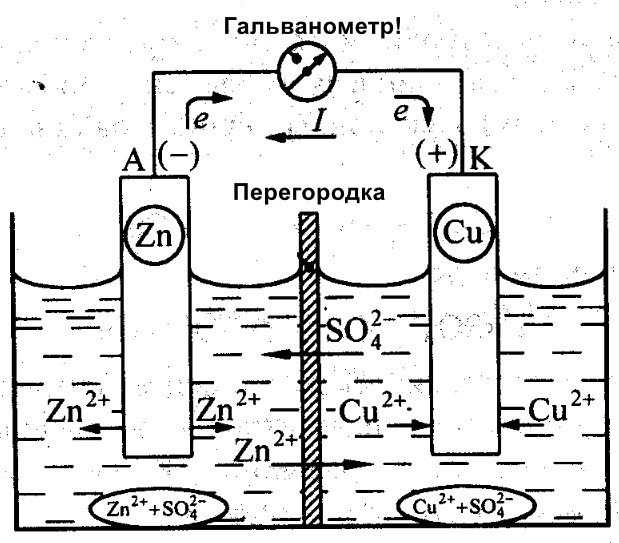
В гальваническом элементе ток течёт от положительного электрода к отрицательному во внешней цепи, а внутри элемента – от анода к катоду. Это направление определяет назначение каждого электрода и выбор материалов для них.
Положительный электрод (катод) принимает электроны из внешней цепи. Это происходит потому, что в катодной полуреакции происходит восстановление. Следовательно, материалы для катода выбираются с учётом их высокой электрохимической стабильности и способности к приёму электронов. Например, в элементах типа Leclanché катодом служит диоксид марганца (MnO₂), обладающий выраженными окислительными свойствами.
Отрицательный электрод (анод) отдаёт электроны, участвуя в окислительной реакции. Он должен легко терять электроны, поэтому для анодов выбираются металлы с низким потенциалом окисления, например, цинк или литий. Это обеспечивает стабильный и направленный поток электронов через внешнюю цепь.
Выбор материалов строго подчинён направлению тока: если изменить полярность, изменятся и функции электродов. Таким образом, направление тока определяет, какой электрод станет источником электронов, а какой – их приёмником, что критически важно для устойчивой работы элемента и предотвращения обратимых реакций.
Почему один электрод окисляется, а другой восстанавливается
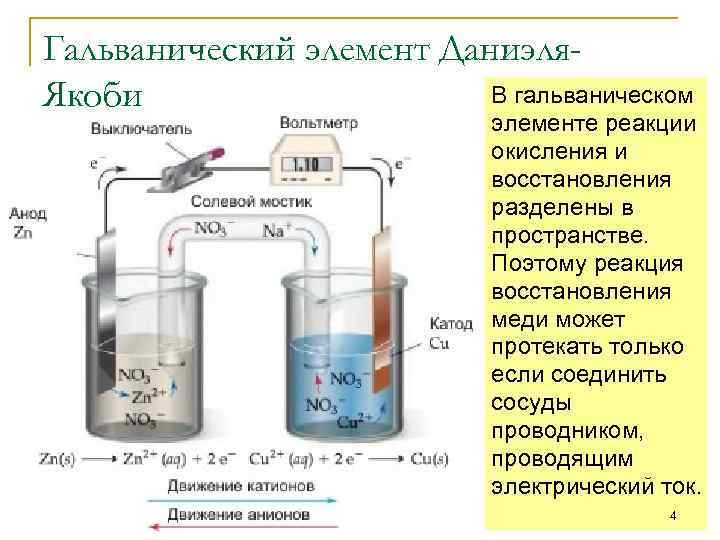
Различие в поведении электродов связано с их электрохимическими потенциалами. Электрод с более низким стандартным электродным потенциалом теряет электроны – на нём происходит окисление. Такой электрод называется анодом. В гальваническом элементе он всегда отрицателен, поскольку отдает электроны во внешнюю цепь.
Другой электрод имеет более высокий стандартный потенциал и принимает электроны – на нём происходит восстановление. Он называется катодом и является положительным, так как притягивает электроны из внешней цепи. Это не результат внешнего источника, а следствие различия в энергии взаимодействия ионов с металлом.
Например, в элементе Daniell медный электрод восстанавливается (Cu²⁺ + 2e⁻ → Cu), так как потенциал Cu²⁺/Cu выше, чем потенциал Zn²⁺/Zn. Цинковый электрод, в свою очередь, окисляется (Zn → Zn²⁺ + 2e⁻). Таким образом, направление переноса электронов зависит исключительно от природы участвующих веществ и их склонности к отдаче или приёму электронов.
Для расчёта этих процессов используют таблицы стандартных электродных потенциалов, где окислитель с более высоким потенциалом восстанавливается, а восстановитель с более низким – окисляется. Это позволяет предсказать, какой электрод будет анодом, а какой – катодом в конкретной электрохимической системе.
Примеры гальванических элементов с указанием полярности электродов
Пример 1: Элемент Даннеля. В этом элементе положительный электрод – медный, а отрицательный – цинковый. Окисление происходит на цинковом электроде, который теряет электроны, а медный электрод восстанавливает ионы меди, получая электроны. Медь выполняет роль катода, а цинк – анода.
Пример 2: Элемент Леконта. В этом типе элемента используется серебро на катоде (положительный электрод) и цинк на аноде (отрицательный электрод). Преимущество данного элемента заключается в высокой стабильности работы и долговечности.
Пример 3: Элемент с соляным раствором. В нем используются два электрода: медный и графитовый. Графитовый электрод служит катодом (положительным), а медный – анодом (отрицательным). В этом элементе медь окисляется, а графит восстанавливает ионы.
Пример 4: Элемент с литиевой батареей. В литиевых элементах анодом является литий, а катодом может быть соединение на основе графита или металла. В процессе работы электроны движутся от лития (отрицательный электрод) к графиту (положительный электрод), что приводит к получению тока.
Пример 5: Элемент с натрием и серой. Положительный электрод в этом элементе – сера, а отрицательный – натрий. В процессе окисления натрий теряет электроны, которые затем восстанавливают серу на катоде.
Вопрос-ответ:
Какие электроды считаются положительными и отрицательными в гальваническом элементе?
В гальваническом элементе положительный электрод называется катодом, а отрицательный — анодом. На катоде происходит восстановление, где ионы восстанавливаются до атомов или молекул, а на аноде — окисление, где атомы или молекулы теряют электроны.
Как определить, какой электрод положительный, а какой отрицательный в гальваническом элементе?
Чтобы определить полярность электродов, нужно обратить внимание на направление тока. Ток всегда течет от отрицательного электрода (анода) к положительному (катоду) в внешней цепи. Это также связано с процессами окисления на аноде и восстановления на катоде.
Почему один электрод окисляется, а другой восстанавливается в гальваническом элементе?
Окисление и восстановление происходят из-за разницы в электрохимических потенциалах. На аноде, который является отрицательным электродом, атомы теряют электроны, а на катоде, который является положительным, эти электроны восстанавливают ионы, превращая их в атомы или молекулы.
Как материалы электродов влияют на их поведение в гальваническом элементе?
Материалы электродов выбираются таким образом, чтобы обеспечить максимальную эффективность химических реакций. Например, для катода часто используют материалы с высокой электрохимической активностью, такие как платина или углерод, которые способствуют восстановлению, а для анода — металлы, легко отдающие электроны, например, цинк.
Какое практическое значение имеет знание полярности электродов в гальваническом элементе?
Знание полярности электродов важно для корректного использования гальванических элементов в различных устройствах, например, в аккумуляторах, источниках питания и электролизерах. Правильное подключение электродов позволяет обеспечить эффективную работу устройства, предотвращая его повреждение и увеличивая срок службы.
Как определяется полярность электродов в гальваническом элементе?
Полярность электродов в гальваническом элементе определяется в зависимости от химических реакций, происходящих на каждом из них. Положительный электрод — это катод, на котором происходит восстановление, то есть химическая реакция, при которой электроны присоединяются к ионам. Отрицательный электрод — это анод, на котором происходит окисление, то есть потеря электронов веществом. Внешнее соединение между электродами позволяет электронам двигаться от анода к катоду, создавая электрический ток. Окислительные реакции происходят на аноде, а восстановительные — на катоде, что и определяет их полярность.